|
感染318天,体内变异40次!最长COVID-19病例揭示新冠病毒的“超级进化史”当新型冠状病毒(SARS-CoV-2)肺炎(COVID-19)疫情最初在全球蔓延之时,几乎所有人都期待着疫苗和药物尽快问世,从而终结这场疫情。然而,随着病毒的不断变异,具有更高传染性或更致命的突变毒株层出不穷,这场抗疫远未达到终点。 根据美国疾病控制与预防中心 (CDC) 内部报告,Delta突变株基础传染值(R0)达5-9.5,远超过原始毒株1.5-3.5的数值,传播速度与水痘相当。与此同时,疫苗也难以阻挡病毒的脚步,1.62 亿接种了疫苗的美国人中每周约有 35,000 例有症状的突破性感染,疫苗接种者感染Delta毒株的风险仅比未接种者降低3倍。 体液免疫和细胞免疫是人体对抗外来病毒入侵的两条重要防线,也是新冠疫苗起作用的两条重要途径。其中体液免疫机制能够识别和捕捉体液中的病毒并予以消灭;而细胞免疫则是人体的最后一条防线,主要由T细胞来“追杀”第一条防线外的“漏网之鱼”。先前的研究表明,大部分的病毒突变是在缺乏体液免疫反应的情况下累积的,而关于细胞免疫在病毒进化方面的作用的研究仍然较少。 近日,俄罗斯Smorodintsev流感研究所及Skoltech大学等处的研究人员共同在预印本平台《Research Square》发表了一篇题为“ SARS-CoV-2 escape from cytotoxic T cells during long-term COVID-19 ”的文章,通过对一名感染SARS-CoV-2长达318 天的免疫功能低下的癌症患者的数据进行分析,揭示了病毒突变以逃避细胞免疫的机制。
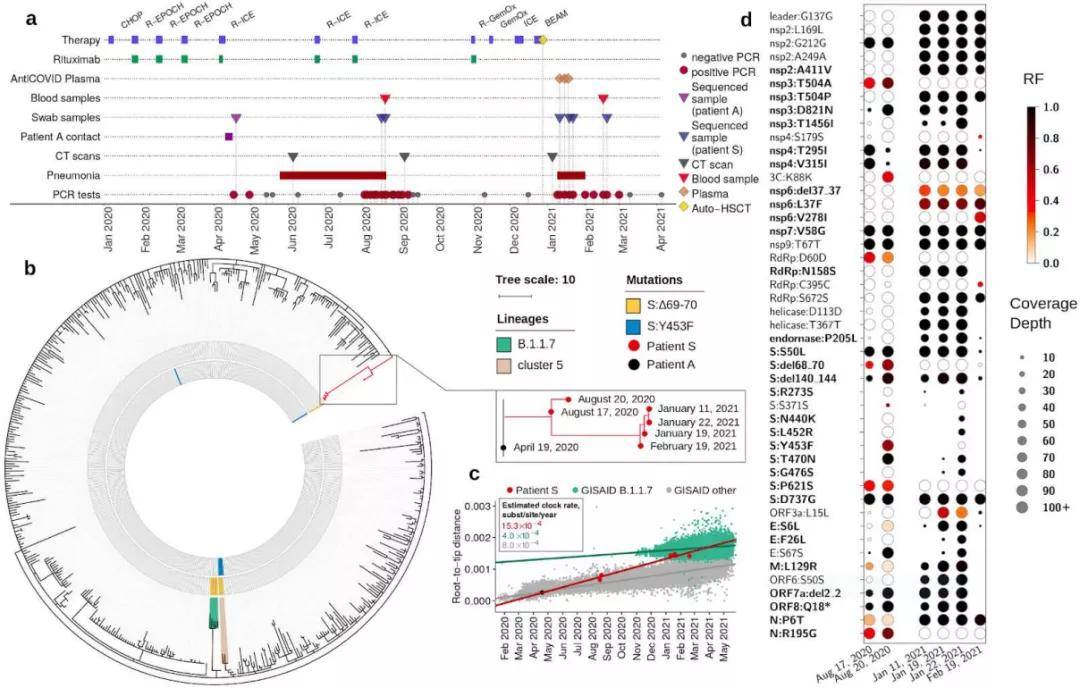
这项报告提到的主人公是一位被诊断为晚期非霍奇金弥漫性大B细胞淋巴瘤的女性患者,于2020年4月17日首次被检测出SARS-CoV-2阳性,并且感染状态持续到2021年3月。感染期间,患者曾两度发展为重症COVID-19,持续时间分别为3个月和2个月,并且研究人员在这两个时期从患者6个鼻咽拭子样本中分离出了活病毒。 对这6个鼻咽拭子样本的基因测序结果表明,导致这名患者两度陷入重症状态的是同一谱系的毒株。病毒在患者体内不断变异,最终积累了40 个突变,远超一般人群中SARS-CoV-2的进化率,说明病毒已经适应了人体环境。这些突变分布在整个病毒基因组中,影响了26个病毒基因中的18个,其中有8个突变发生在刺突(S)蛋白基因上。
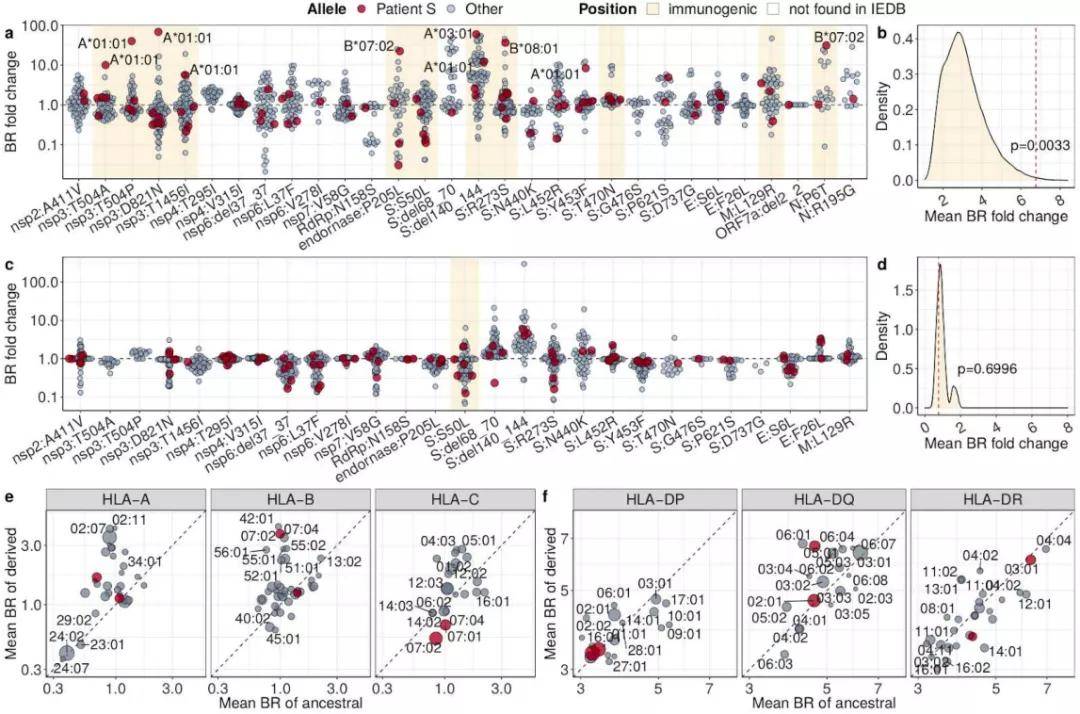
令人疑惑的是,由于这位患者接受了包括利妥昔单抗在内的几种不同方案下的多个化疗周期,这导致患者的体液免疫几乎“失灵”,既然如此,为何病毒仍然会发生如此多的突变?难道是为了躲避细胞免疫吗机制? 流式细胞术分析显示,研究人员确实在患者处于重症COVID-19期间检测到了明显的SARS-CoV-2特异性T细胞反应。而在进一步分析中,研究人员探究了累积的突变是否影响了同种异体抗原HLA的呈递,结果发现有12 个获得性突变降低或阻止了HLA I类等位基因的表达,后者为CD8+T细胞的协同刺激分子,表明病毒突变造成了SARS-CoV-2对CD8+ T细胞的免疫逃逸,导致T细胞反应效率低下。
这些结果表明,宿主内进化确实能够促进SARS-CoV-2对细胞毒性T淋巴细胞的逃逸,这可能是SARS-CoV-2进化过程中一个被低估的因素,应引起重视。 该报告的作者、Skoltech大学的Georgii Bazykin说:“考虑到最近广泛传播的SARS-CoV-2变异株,它们的起源可能有些不寻常。当这种变异株开始酝酿时,通常会迅速累积多个突变,就像我们在这项研究中看到的病毒在免疫抑制个体内进化一样。这可能意味着,一些特殊病例会成为病毒的‘健身房’,使其更好地进化以适应感染人体所需要的体征。尽管我们这项报告中的突变毒株并未流传出去,但也说明病毒进化的锻炼场所比我们想象的更具有多样性。” End |