|
Fate公司iPSC来源的CAR-T细胞疗法完成首例患者给药Fate Therapeutics是一家致力于癌症患者程序化细胞免疫疗法开发的临床阶段生物制药公司,近日宣布,FT819完成首例患者给药,FT819是一种现成的靶向CD19+恶性肿瘤的嵌合抗原受体(CAR)T细胞疗法。
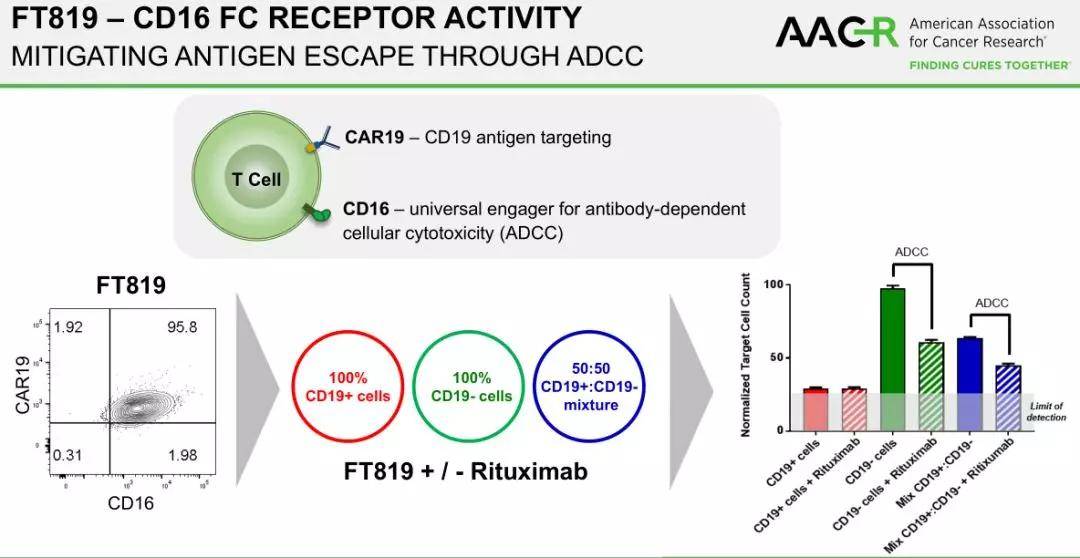
FT819是首个源自克隆主诱导多能干细胞(iPSC)系的CAR-T细胞疗法,iPSC系是一种可再生细胞来源,能够大规模生产高质量的同种异体CAR-T细胞,具有更大的产品一致性、现货供应和更广泛的患者可及性。FT819具有多项首创功能,旨在提高CAR-T胞疗法的安全性和有效性。 推荐阅读:AACR最前沿:黑马Fate公司推出iPSC结合CRISPR产生的「纯」通用CAR-T细胞,或可突破个性化局限,实现规模化生产
Fate Therapeutics总裁兼首席执行官Scott Wolchko表示:“通过患者来源的CAR-T 细胞疗法已经取得了显著的临床结果,但是,需要下一代方法来惠及更多需要这些高效疗法的患者。对首例FT819患者的治疗开创了‘现货’CAR-T细胞治疗的新时代,有可能克服现有患者和供体来源的治疗方法的现实局限性,并释放CAR-T细胞治疗的全部潜力。我们要感谢斯隆-凯特琳癌症中心(MSK)的合作伙伴,他们在过去五年中为这一里程碑式的成就做出了巨大贡献。” FT819旨在专门解决与当前一代患者和供体来源的CAR-T细胞疗法相关的几个局限性。在与斯隆凯特琳癌症中心的合作下,该中心由医学博士、细胞工程中心主任兼基因表达和基因转移实验室主任Michel Sadelain领导,该公司整合了多项首创功能进入FT819包括:
FT819的多中心1期临床试验旨在确定FT819的推荐2期剂量和方案,并评估其在复发/难治性急性淋巴细胞白血病(ALL)、慢性淋巴细胞白血病(CLL)和B细胞淋巴瘤(BCL)成人患者中的安全性和临床活性。 三种治疗方案将在剂量递增中针对每种类型的恶性肿瘤进行独立评估:方案A作为单剂量的FT819;方案B作为单剂量FT819与IL-2细胞因子支持;方案C作为FT819的三个分次剂量。对于每个适应症和方案,都可以招募剂量递增组,以进一步评估FT819的临床活性。第一位复发/难治性ALL患者参加了A方案并接受了9000万个细胞的剂量。 在2021年5月举行的第24届美国基因与细胞治疗学会年会上,该公司提交了临床前数据,证明FT819表现出一致的1XX CAR表达,完全消除了内源性TCR表达。候选产品显示包含干细胞和中枢记忆T细胞表型,激活标记CD25和贩运标记CXCR4的高水平表达和检查点蛋白PD1、TIM3、CTLA4的极低水平表达和LAG3。
此外,功能评估的数据显示,FT819在体外对表达CD19的白血病和淋巴瘤细胞系具有强效的抗原特异性溶细胞活性,可与健康供体来源的CAR-T细胞相媲美,并在淋巴母细胞白血病的体内播散异种移植模型中持续和维持了骨髓中的肿瘤清除。 根据与MSK的许可协议,Fate Therapeutics拥有美国专利号10,370,452所有人类治疗用途的独家许可,专利涵盖表达CAR的效应T细胞的组合和使用,其中此类T细胞来自包括iPSC的多能干细胞。除了MSK授予的专利权外,该公司还拥有广泛的和其他核酸酶对iPSC进行基因组编辑的组合物和方法,包括使用CRISPR在TRAC基因座中插入CAR内源性转录调控。 |